RDC Nº 102, de 24 de agosto de 2016
publicado em 24/08/2016
Ministério da Saúde - AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA
DIRETORIA COLEGIADA
RESOLUÇÃO - RDC Nº 102, DE 24 DE AGOSTO DE 2016
Dispõe sobre os procedimentos para a transferência de titularidade de registro de produtos sujeitos à vigilância sanitária,transferência global de responsabilidade sobreensaio clínico e atualização de dadoscadastrais relativos ao funcionamento e certificaçãode empresas, em decorrência deoperações societárias ou operações comerciais.
A Diretoria Colegiada da Agência Nacional de VigilânciaSanitária, no uso da atribuição que lhe conferem o art. 15, III e IValiado ao art. 7º, III, e IV, da Lei nº 9.782, de 26 de janeiro de 1999,o art. 53, V, §§ 1º e 3º do Regimento Interno aprovado nos termos doAnexo I da Resolução da Diretoria Colegiada - RDC nº 61, de 3 defevereiro de 2016, resolve adotar a seguinte Resolução da DiretoriaColegiada, conforme deliberado em reunião realizada em 12 de julhode 2016, e eu, Diretor-Presidente, determino a sua publicação.
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
Art. 1º Esta Resolução se aplica às operações societárias e àsoperações comerciais entre empresas que exercem atividades previstasna legislação sanitária federal e que resultem na necessidade deatualização de dados cadastrais relativos ao funcionamento e certificaçãode empresas, transferência global de responsabilidade sobreensaio clínico e de transferência de titularidade de registro de produtossujeitos à vigilância sanitária.
Parágrafo único. Esta Resolução também abrange os casosde operações realizadas no exterior que impliquem na necessidade deatualização no âmbito da ANVISA.
Art. 2º Os procedimentos estabelecidos por esta Resolução seaplicam exclusivamente aos casos em que sejam mantidas as condiçõese características técnico-sanitárias das empresas, produtos eensaios clínicos.
Art. 3º Os procedimentos estabelecidos por esta Resoluçãonão se aplicam às mudanças de razão social não relacionadas àsoperações mencionadas no art. 1º desta Resolução, as quais ficamsujeitas às normas específicas em vigor.
Art. 4º Para os fins previstos nesta Resolução são adotadasas seguintes definições:
I - características técnico-sanitárias: condições regulares, juntoà ANVISA, do produto, empresa, ou ensaio clínico, no momentoimediatamente anterior à operação societária ou comercial;
II - cisão: operação societária pela qual uma pessoa jurídicatransfere parcelas do seu patrimônio para uma ou mais pessoas jurídicas,constituídas para esse fim ou já existentes, extinguindo-se asociedade cindida, se houver versão de todo o seu patrimônio, oudividindo-se o seu capital, se parcial a versão;
III - empresa sucedida: pessoa jurídica que cede à empresasucessora os direitos e obrigações sobre o produto objeto de transferênciade titularidade de registro, sobre o estabelecimento, ou sobrea responsabilidade de ensaio clínico, em decorrência de operaçõessocietárias ou comerciais;
IV - empresa sucessora: pessoa jurídica que passa a terdireitos e obrigações sobre o produto objeto da transferência de titularidadede registro, sobre estabelecimento, ou sobre a responsabilidadede ensaio clínico, em decorrência de operações societárias oucomerciais;
V - fusão: operação societária pela qual se unem duas oumais pessoas jurídicas para formar uma terceira, que lhes sucederá emtodos os direitos e obrigações;
VI - incorporação: operação societária pela qual uma ou maispessoas jurídicas são absorvidas por outra, que lhes sucede em todosos direitos e obrigações;
VII - operação comercial: operação entre empresas que resultena venda de ativos ou de um conjunto de ativos, sem a ocorrênciade qualquer operação societária entre elas;
VIII - operação societária: ato empresarial que envolve acisão, fusão ou incorporação nos termos da Lei nº 10.406, de 10 dejaneiro de 2002 e, de forma subsidiária, da Lei nº 6.404, de 15 dedezembro de 1976;
IX - representante Mercosul: empresa localizada no EstadoParte Receptor (EPR), contratada para representar uma empresa titularde um registro de produto no Estado Parte Produtor (EPP) e queassume a responsabilidade legal e técnica no EPR;
X - transferência global de responsabilidade sobre ensaioclínico: alteração caracterizada pela mudança do solicitante de dossiêsde ensaios clínicos, de notificação de ensaio clínico, de dossiês dedesenvolvimento clínico de medicamentos (DDCM), dossiês de investigaçãoclínica de dispositivos médicos (DICD), de programas deacesso expandido, de programas de uso compassivo e de fornecimentode medicamento pós-estudo, nos casos de operações societáriasou operações comerciais, sem que seja conferida qualquer mudançadas características técnico-sanitárias constantes no Comunicado EspecialEspecífico (CEE), Documento para Importação de Produto sobInvestigação ou Comunicado Especial (CE), objeto da alteração;
XI - transferência de titularidade de registro: alteração caracterizadapela mudança do titular do registro de produtos sujeitos àvigilância sanitária, nos casos de operações societárias ou operaçõescomerciais, sem que seja realizada qualquer mudança das característicastécnico-sanitárias no registro do produto objeto da transferência.
Art.5º As empresas deverão, em decorrência de operaçõessocietárias ou comerciais, realizar peticionamento de atualização dedados cadastrais relativos ao funcionamento e certificação de empresas,transferência global de responsabilidade sobre ensaio clínico ede transferência de titularidade de registro de produtos sujeitos àvigilância sanitária, nos termos desta Resolução.
Parágrafo único. Em caso de operações societárias ou comerciaissucessivas, é necessário realizar o peticionamento para cadaoperação realizada.
Art. 6º A partir da efetivação da operação societária oucomercial, a empresa sucessora sub-roga-se quanto aos direitos eobrigações da empresa sucedida, inclusive no que se refere ao cumprimentode prazos e regras de adequação à legislação sanitária eeventuais medidas restritivas impostas à circulação de produtos.
CAPÍTULO II
DA ATUALIZAÇÃO DOS DADOS CADASTRAIS
Art. 7° As empresas deverão protocolizar junto à ANVISA,as solicitações de alteração, concessão e ou cancelamento de Autorizaçãode funcionamento de Empresa (AFE) e Autorização Especial(AE), de atualização de Certificado de Boas Práticas de Fabricação(CBPF) ou Certificado de Boas Práticas de Distribuição eArmazenamento (CBPDA), e de atualização de Certificado de BoasPráticas de Biodisponibilidade/Bioequivalência de Medicamentos(CBPBD/BE), sempre que ocorrida a operação societária ou comercial.
SeçãoI
Da Autorização de Funcionamento de Empresa (AFE) e daAutorização Especial (AE)
Art. 8º As empresas deverão solicitar a atualização de AFE eAE por meio de petição de alteração, cancelamento, ou concessão,sempre que ocorrida a operação societária.
Art. 9º Quando a operação societária resultar em uma novapessoa jurídica, ou pessoa jurídica já existente não regularizada juntoà vigilância sanitária, a regularização dar-se-á por meio de pedido deconcessão inicial de AFE e AE.
Art. 10 O pedido de cancelamento da AFE e AE deve serprotocolado, pela empresa sucedida, em até 30 (trinta) dias após apublicação da Resolução de cancelamento e de transferência de titularidadede registros, quando for o caso.
Parágrafo único. Somente após a transferência de titularidadede todos os registros da empresa sucedida para uma ou mais empresassucessoras, haverá o cancelamento da AFE e AE da empresa sucedida.
Art.11 A petição para atualização de dados na AFE ou naAE deverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;e
II - declaração da operação societária praticada, conformedisposto no Anexo I.
Seção II
Da Certificação em Boas Práticas
Sub-seção I
Da Certificação em Boas Práticas de Fabricação e da Certificaçãoem Boas Práticas de Distribuição e Armazenamento
Art. 12 A empresa sucessora deverá solicitar atualização dosdados cadastrais referentes aos estabelecimentos envolvidos no CBPF,ou no CBPDA desde que inalteradas as características técnico-sa-nitáriaspreviamente examinadas, sempre que ocorrida a operaçãosocietária ou comercial.
§1º A atualização de que trata o caput deste artigo nãoimplica em nova certificação, mantendo-se inalterado o prazo devalidade do certificado publicado anteriormente à operação.
§2º A atualização de dados no CBPF dar-se-á por linha deprodução e será aplicável somente nos casos em que as operaçõessocietárias ou comerciais envolverem a totalidade desta linha produtiva.
§3ºNo caso de operações societárias ocorridas exclusivamenteno exterior, a atualização de que trata o caput deste artigo deveser peticionada pela atual empresa solicitante da certificação vigente.
Art.13 A petição para atualização de dados no CBPF ou noCBPDA deverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;
II- cópia do CBPF ou CBPDA vigente, no caso em que estetenha sido publicado anteriormente à operação;
III - declaração da operação societária ou comercial praticada,conforme disposto nos Anexos;
IV - cópia da publicação em DOU da AFE ou AE atualizada,no caso em que a operação societária resultar em alteração ou concessãode AFE ou AE; e
V - cópia do CBPF vigente em nome da empresa sucessora,emitido pela autoridade sanitária do país onde está instalado o estabelecimentoprodutor ou declaração desta autoridade atestando aoperação, no caso de operação societária ocorrida no exterior.
Art. 14 A atualização de dados no CBPF ou CBPDA não seaplica a pedidos de certificação inicial que estejam aguardando análiseou com análise ainda não concluída.
§1º Para os casos previstos no caput, a empresa sucedidadeverá promover o aditamento da petição para atualização da documentação,com vistas à instrução e o prosseguimento da análise dapetição em andamento.
§2º A empresa sucedida deverá apresentar os documentosprevistos no art. 13 desta Resolução.
Sub-seção II
Da Certificação em Boas Práticas de Biodisponibilidade/Bioequivalênciade Medicamentos
Art. 15 A empresa sucessora deverá solicitar atualização dosdados cadastrais referentes aos estabelecimentos envolvidos noCBPBD/BE, desde que inalteradas as características técnico-sanitáriaspreviamente examinadas, sempre que ocorrida a operação societária.
§1º A atualização de que trata o caput deste artigo nãoimplica em nova certificação, mantendo-se inalterado o prazo devalidade do certificado publicado anteriormente à operação.
§2º No caso de operações societárias ocorridas exclusivamenteno exterior, a atualização de que trata o caput deste artigo deveser peticionada pela atual empresa solicitante da certificação vigente.
Art.16 A petição para atualização de dados no CBPBD/BEdeverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;
II- cópia do CBPBD/BE vigente; e
III - declaração da operação societária praticada, conformedisposto no Anexo I.
Art. 17 A petição de atualização no CBPBD/BE não seaplica a pedidos de certificação inicial, que estejam aguardando análiseou com análise ainda não concluída.
§1º Para os casos previstos no caput, a empresa sucedidadeverá promover o aditamento da petição para atualização da documentação,com vistas à instrução e o prosseguimento da análise dapetição em andamento.
§2º A empresa sucedida deverá apresentar os documentosprevistos no art. 16 desta Resolução.
CAPÍTULO III
DA TRANSFERÊNCIA DE TITULARIDADE
Seção I
Dos Agrotóxicos, seus Componentes e Afins
Art. 18 A empresa sucessora deverá comunicar à ANVISA atransferência de titularidade de registro de agrotóxicos, seus componentese afins, no órgão federal registrante, de acordo com o estabelecidono Decreto nº 4.074, de 04 de janeiro de 2002, no prazo de60 (sessenta) dias, por meio de petição de notificação de alteração datitularidade, sempre que ocorrida a operação societária ou comercial.
Art.19 A petição de notificação de alteração da titularidadedeverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;e
II - cópia do DOU comprovando a transferência de titularidadeno órgão federal registrante.
Seção II
Dos Produtos Fumígenos Derivados ou Não do Tabaco
Art. 20 As empresas deverão atualizar os dados relativos aoregistro de produtos fumígenos junto à ANVISA, por meio de petiçãode transferência de titularidade e de cancelamento de registro, sempreque ocorrida operação societária ou comercial que implique em alteraçãoda titularidade dos registros.
Art. 21 As petições de transferência de titularidade e decancelamento de registro deverão ser concomitantemente protocolizadasjunto à ANVISA, respectivamente pelas empresas sucessora esucedida, no prazo de até 60 (sessenta) dias.
§1º As petições protocolizadas fora do prazo previsto nocaput deste artigo serão indeferidas pela ANVISA.
§2º O prazo referido no caput deste artigo contar-se-á a partirda data do arquivamento do ato societário registrado na junta comercialcompetente, ou da celebração do instrumento contratual detransferência de ativos ou de um conjunto de ativos, conforme ocaso.
§3º No caso de representante Mercosul, o prazo previsto nocaput deste artigo será contado a partir da data em que formalmentefor interrompida a relação contratual entre a empresa representanteMercosul domiciliada e titular de registro no Brasil e a empresarepresentada, titular de registro em outro Estado Parte do Mercosul.
Art. 22 A transferência de titularidade de produtos fumígenosimplica em publicação simultânea, no DOU, do novo registro edo cancelamento do registro antigo, mantendo-se inalteradas as característicastécnico-sanitárias do produto e o prazo de validade doregistro objeto de transferência.
Art. 23 A petição de transferência de titularidade de registrodeverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;
II- declaração da operação societária ou comercial praticada,conforme disposto no Anexo I;
III - comprovante de Inscrição e de Situação Cadastral juntoà Secretaria de Receita Federal do Brasil - Cadastro Nacional dePessoa Jurídica (CNPJ); e
IV - cópia do Ato Declaratório Executivo (ADE) de concessãodo Registro Especial de Fabricante ou Importador, quando setratar de produto do tipo cigarro ou cigarrilha, expedido pela Secretariade Receita Federal do Brasil, já referente à empresa sucessora.
Art.24 As operações societárias ou comerciais que envolvama transferência de direitos e obrigações relativos a pedidos deregistro que estejam aguardando análise ou com análise ainda nãoconcluída, não caracterizam transferência de titularidade.
§1º Para os casos previstos no caput, a empresa sucedidadeverá promover o aditamento da petição para atualização da documentação,com vistas à instrução e o prosseguimento da análise dapetição em andamento.
§2º A empresa sucedida deverá apresentar os documentosprevistos no art. 23 desta Resolução.
Seção III
Dos Medicamentos, Insumos Farmacêuticos Ativos, Cosméticos,Saneantes, Produtos para Saúde e Alimentos
Art. 25 As empresas deverão atualizar os dados relativos aoregistro de produtos sujeitos à vigilância sanitária, por meio de petiçãode transferência de titularidade e de cancelamento de registro,sempre que ocorrida operação societária ou comercial que impliquena alteração da titularidade do registro de produtos.
Art. 26 As petições de transferência de titularidade e decancelamento de registro deverão ser concomitantemente protocolizadasjunto à ANVISA, respectivamente pelas empresas sucessora esucedida, no prazo de até 180 (cento e oitenta) dias.
§1º As petições protocolizadas fora do prazo previsto nocaput deste artigo serão indeferidas pela ANVISA.
§2º O prazo referido no caput deste artigo contar-se-á a partirda data do arquivamento do ato societário registrado na junta comercialcompetente, ou da celebração do instrumento contratual detransferência de ativos ou de um conjunto de ativos, conforme ocaso.
§3º No caso de representante Mercosul, o prazo previsto nocaput deste artigo será contado a partir da data em que formalmentefor interrompida a relação contratual entre a empresa representanteMercosul domiciliada e titular de registro no Brasil e a empresarepresentada, titular de registro em outro Estado Parte do Mercosul.
Art. 27 Os produtos sujeitos a cadastro se equiparam àquelessujeitos a registro para fins de transferência de titularidade dos registros.
Art.28 Os produtos sujeitos a notificação e os isentos deregistro não são objetos de transferência de titularidade, devendo aempresa sucessora realizar nova notificação ou novo procedimento deregularização, conforme o caso.
Art. 29 A transferência de titularidade de registro implica napublicação simultânea, no DOU, do novo número de registro e docancelamento do número antigo, mantendo-se inalteradas as característicasdo produto e o prazo de validade do registro objeto detransferência.
Art. 30 A petição de transferência de titularidade de registrodeverá ser instruída com os seguintes documentos:
I - formulário de petição devidamente preenchido e assinado;
II- comprovante de pagamento ou de isenção da Taxa deFiscalização de Vigilância Sanitária (TFVS), mediante Guia de Recolhimentoda União (GRU);
III - declaração da operação societária ou comercial praticada,conforme disposto no Anexo I; e
IV - cópia da licença de funcionamento ou do alvará sanitárioexpedido pelo órgão competente, devidamente atualizada apósa operação societária ou comercial.
Art. 31 As operações societárias ou comerciais que envolvama transferência de direitos e obrigações relativos a pedidos deregistro que estejam aguardando análise, ou com análise ainda nãoconcluída, não caracterizam transferência de titularidade.
§1º Para os casos previstos no caput, a empresa sucedidadeverá promover o aditamento da petição para atualização da documentação,com vistas à instrução e o prosseguimento da análise dapetição em andamento.
§2º A empresa sucedida deverá apresentar os documentosprevistos no art. 30 desta Resolução.
Art. 32 As petições pós-registro já protocolizadas pela empresasucedida e que estejam aguardando análise ou com análiseainda não concluída poderão ser transferidas para a empresa sucessora,mediante apresentação da declaração de interesse disposta noAnexo I.
Parágrafo único. As petições pós-registro que não constaremda declaração disposta no Anexo I caracterizarão desistência por parteda empresa sucessora e serão encerradas pela ANVISA.
Art. 33 As adequações nos textos de instruções de uso, bulase rotulagens, decorrentes de transferência de titularidade, poderão serimplementadas após a aprovação da petição de transferência de titularidadepela ANVISA.
§1º As adequações nos textos de instruções de uso, bulas erotulagens de que tratam o caput deste artigo estão restritas à atualizaçãode dados do titular do registro.
§2º No caso de medicamentos, a empresa sucessora terá oprazo de até 30 (trinta) dias, após a entrada em vigor das Resoluçõesde cancelamento e de transferência de titularidade de registros, parapeticionar a Notificação de alteração do texto de bula e Notificaçãode alteração de rotulagem relacionada às características da nova empresatitular do registro.
Art. 34 Em decorrência da transferência de titularidade serápermitida a manutenção de nomes diferentes ou distintos para medicamentoscom o(s) mesmo(s) princípio(s) ativo(s).
CAPÍTULO IV
DA TRANSFERÊNCIA GLOBAL DE RESPONSABILIDADESOBRE ENSAIO CLÍNICO
Art. 35 A empresa sucedida deverá atualizar os dados relativosao ensaio clínico por meio de petição de transferência globalde responsabilidade sobre ensaio clínico, sempre que ocorrida a operaçãosocietária ou comercial.
Art. 36 A petição de transferência global de responsabilidadesobre ensaio clínico deverá ser instruída com os seguintes documentos:
I- formulário de petição devidamente preenchido e assinado;e
II - declaração da operação societária ou comercial praticada,conforme disposto no Anexo I.
Art. 37 Para solicitações de transferência global de responsabilidadesobre ensaio clínico, mesmo aqueles sob responsabilidadede Organização Representativa de Pesquisa Clínica (ORPC), seráemitido o Comunicado Especial, Comunicado Especial Específico ouDocumento para Importação de Produto sob Investigação em nomedo novo responsável pelo respectivo processo.
CAPÍTULO V
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
Art. 38 As importações pela empresa sucessora, com base naAFE da empresa sucedida, serão permitidas até que ocorra a decisãoda ANVISA sobre a regularização da empresa, desde que obedecidosos prazos para protocolo estabelecidos por esta Resolução.
Parágrafo único. A empresa importadora deverá apresentarcópia autenticada da declaração da operação praticada para a autoridadesanitária do local de desembaraço, como documento comprobatórioda operação societária ou comercial, conforme disposto noAnexo I.
Art. 39 A responsabilidade pelo produto e pelo eventualestoque remanescente dos produtos acabados recairá sobre a empresasucessora, inclusive para fins de importação, nos casos de transferênciade titularidade de registro.
§1º Até que ocorra a transferência de titularidade dos registrosdos produtos na ANVISA, as importações realizadas pelaempresa sucessora deverão ser acompanhadas de declaração da empresasucedida, signatária da petição de regularização do produtojunto à ANVISA, autorizando a importação.
§2º O disposto no caput deste artigo não exclui a responsabilidadesolidária da empresa sucedida perante os órgãos e entidadesde vigilância sanitária pelos atos praticados anteriormente àoperação societária ou comercial.
Art. 40 O estoque remanescente dos produtos acabados objetosda transferência de titularidade poderá ser regularmente importadoou comercializado pelo novo titular do registro, desde quetenha sido produzido antes da entrada em vigor das Resoluções decancelamento e de transferência de titularidade de registros.
Parágrafo único. As empresas terão um prazo máximo de180 (cento e oitenta) dias, após a entrada em vigor das Resoluções decancelamento e de transferência de titularidade de registros, paraesgotamento de estoque remanescente dos produtos acabados.
Art. 41 Não serão permitidos o uso e o esgotamento deeventual estoque remanescente de embalagens com dizeres ou informaçõesde rotulagem desatualizados para novos lotes produzidosapós a entrada em vigor das Resoluções de cancelamento e de transferênciade titularidade de registros.
Art. 42 As disposições contidas nos artigos 39, 40 e 41 nãose aplicam aos produtos agrotóxicos, seus componentes e afins, porestarem sujeitos às normas estabelecidas pelo órgão federal registrante.
Art.43 As petições de transferência de titularidade de registrode produtos em decorrência de operações societárias, protocoladasantes da data de vigência desta Resolução serão analisadasconforme Resolução vigente à época do protocolo.
Art. 44 Os prazos para protocolo estabelecidos por esta Resoluçãonão incidirão sobre as petições de transferência de titularidadede registro de produtos em decorrência de operações comerciaisrealizadas anteriormente à vigência desta Resolução.
Parágrafo único. Nos casos enquadrados no caput, as empresaspoderão protocolizar junto à ANVISA, no prazo de até 180(cento e oitenta) dias a partir da vigência desta Resolução, as solicitaçõesconcomitantes de transferência de titularidade e de cancelamentodo registro do produto, conforme o caso.
Art. 45 As empresas envolvidas nas operações societárias ecomerciais deverão prestar informações e apresentar documentoscomplementares, sempre que solicitadas pela ANVISA.
Art. 46 A ANVISA poderá, a qualquer momento, solicitarcópia da certidão do arquivamento do ato societário registrado, emcaso de operação societária, ou do instrumento contratual de transferênciade ativos ou de um conjunto de ativos, em caso de operaçãocomercial.
Art. 47 Salvo disposição em contrário, as Resoluções decancelamento e de transferência de titularidade de registro de produtossujeitos à vigilância sanitária de que trata esta Resolução começama vigorar 90 (noventa) dias depois de sua publicação.
Art. 48 O retardamento, omissão ou a prestação de informaçõesfalsas ou enganosas, em desacordo com o disposto nestaResolução, constitui infração sanitária, sujeitando o infrator às penalidadesprevistas na Lei nº 6.437, de 20 de agosto de 1977, semprejuízo da responsabilidade civil e penal prevista nas normas aplicáveisvigentes.
Art. 49 Ficam revogadas a Resolução da Diretoria Colegiada- RDC nº 22, de 17 de junho de 2010, a Instrução Normativa nº 03,de 03 de maio de 2012, e o item 4, Capítulo III do Anexo da RDC nº323, de 10 de novembro de 2003.
Art. 50 Esta Resolução entra em vigor no prazo de 120(cento e vinte) dias, contados a partir da data de sua publicação.
JARBAS BARBOSA DA SILVA JÚNIOR


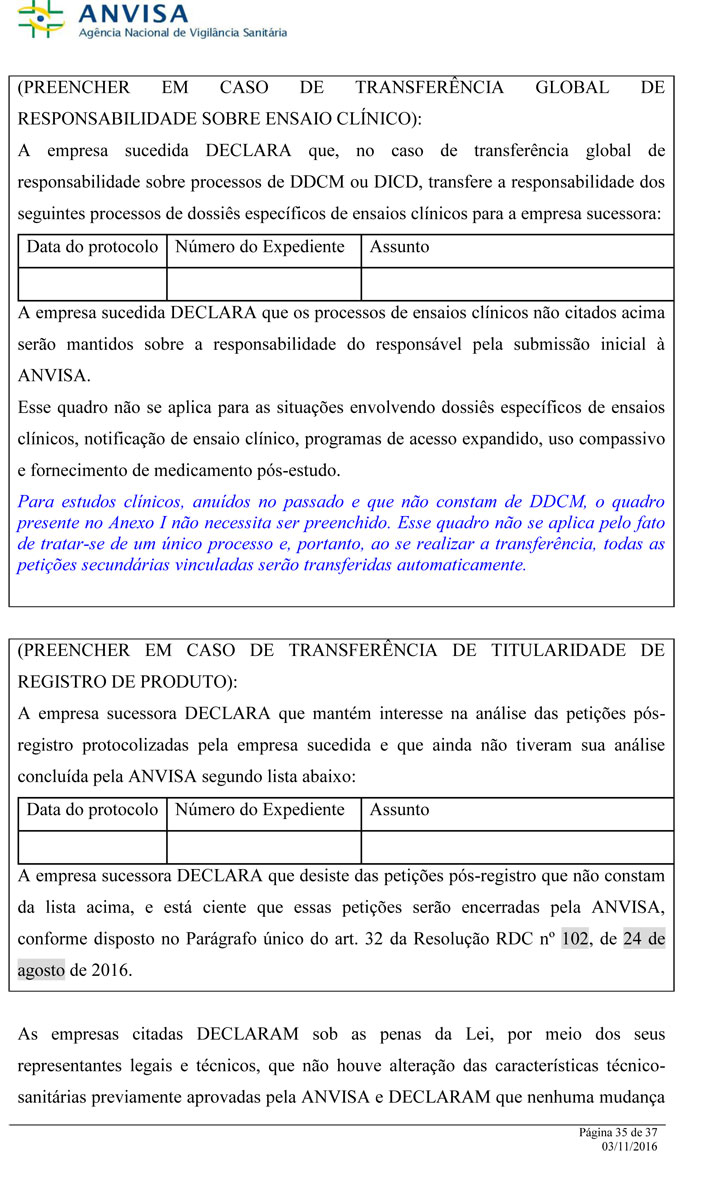

As empresas citadas DECLARAM sob as penas da Lei, por meio dos seus representantes legais e técnicos, que não houve alteração das características técnico-sanitárias previamente aprovadas pela ANVISAe DECLARAM que nenhuma mudança nas características técnico-sanitárias será realizada até que haja autorização, aprovação ou certificação da atividade, de acordo com os atos formais respectivos expedidos pelaANVISA.
As empresas citadas DECLARAM SOB AS PENAS DA LEI, por meio dos seus representantes legais e técnicos, que as informações acima prestadas são a expressão da verdade e ambas assumemresponsabilidade solidária pela sua exatidão.
ANEXO II


Este conteúdo não substitui o publicado na versão certificada.


Deixar comentário
Para comentar é preciso fazer login no sistema.