O Papel da Embalagem na Preservação
publicado em 01/08/1998
Daniel K Brannan
Abilene Christian University, Abilene IX, Estados Unidos
 Este artigo explora a ideia de que a embalagem e o fechamento são fatores importantes na contaminação microbiana de um produto durante o uso pelo consumidor. Não se pode afirmar que a conservação química é o principal meio utilizado para controlar a contaminação. Os dados apresentados neste artigo mostram a razão pela qual é importante desenhar embalagens que impeçam a contaminação introduzida pelo consumidor em vez de confiar apenas nos agentes preservantes nas provas de eficácia de preservação.
Este artigo explora a ideia de que a embalagem e o fechamento são fatores importantes na contaminação microbiana de um produto durante o uso pelo consumidor. Não se pode afirmar que a conservação química é o principal meio utilizado para controlar a contaminação. Os dados apresentados neste artigo mostram a razão pela qual é importante desenhar embalagens que impeçam a contaminação introduzida pelo consumidor em vez de confiar apenas nos agentes preservantes nas provas de eficácia de preservação.
 This article explores the idea that the package and closure are significant factors in prevening microbial contamination of a product during consumer use. Chemical presentation was never intended to be the main avenue of controlling contamination. The data presented in this article show why it is important to design packages that prevent consumer-introduced contamination rather than rely on preservatives and preservative efficacy test alone.
This article explores the idea that the package and closure are significant factors in prevening microbial contamination of a product during consumer use. Chemical presentation was never intended to be the main avenue of controlling contamination. The data presented in this article show why it is important to design packages that prevent consumer-introduced contamination rather than rely on preservatives and preservative efficacy test alone.
 Esde artículo explora la idea de que el envase y el cierre son factores importantes el la prevención de la contaminación microbiana de un producto durante el uso por parte del consumridor. No se trató nunca de que la conservación química fruera el medio principal utilizado para controlar la contaminación. Los datos nação. Los dados presentados em este artículo muestran razón por la que es importante diseñar envases que impidam la contaminación introducida por el consumidor en vez de confiar solamente en agentes preservantes y en las pruebas eficacia de preservación.
Esde artículo explora la idea de que el envase y el cierre son factores importantes el la prevención de la contaminación microbiana de un producto durante el uso por parte del consumridor. No se trató nunca de que la conservación química fruera el medio principal utilizado para controlar la contaminación. Los datos nação. Los dados presentados em este artículo muestran razón por la que es importante diseñar envases que impidam la contaminación introducida por el consumidor en vez de confiar solamente en agentes preservantes y en las pruebas eficacia de preservación.
O Fator de Prevenção
Regulamentação
Expansão dos Micróbios
Breve História de PETs e de Controle Microbiológico
Resultados de PET in vitro
Embalagem: Protetor contra Contaminação
Outras Considerações
Rótulos
O Futuro
A embalagem e o fechamento de um produto podem ter influência significativa na prevenção de contaminação microbiana durante o uso pelo consumidor. Bem mais do que uma consideração de saúde, a prevenção de contaminação microbiana pode ter impacto econômico para a indústria; a confiança despertada nos consumidores pelas características estéticas de um produto - aparência, textura e fragrância – pode ajudá-los a decidir se um produto merece ser novamente adquirido.1 A deterioração microbiana, mesmo em produtos minimamente contaminados, pode decompor um cosmético a ponto de destruir essas características. Este artigo explora as bases fisiológicas, históricas e de regulamentação, para que se considere a embalagem um mecanismo de proteção dos produtos.
O propósito primário da adição de preservantes a um produto cosmético não é o de eliminar a contaminação durante a fabricação ou o uso pelo consumidor. Um preservante é adicionado mais propriamente apenas para controlar baixos níveis de microrganismos inevitáveis que ocasionalmente entram no produto por uma dessas vias. O produto pode também ser suficientemente hostil para eliminar microrganismos transitórios pela formulação com ingredientes inerentemente hostis. Mas a preservação nunca teve por finalidade controlar a contaminação devida à fabricação descuidada ou às embalagens inadequadamente desenvolvidas.
O Fator de Prevenção
Desenvolver embalagens para prevenir a contaminação microbiana durante o uso é como dar alguns passos para evitar doenças. A melhor maneira de prevenir uma doença é, em primeiro lugar, evitar a exposição. A embalagem e o dispositivo dispensador, se apropriadamente desenhados, podem prevenir o produto da constante exposição a microrganismos durante o uso,
Se não se escolhe a prescrição para evitar doenças, uma outra forma de combatê-las, os antibióticos, então é necessária. Para o químico cosmético, isto significa confiar nos preservantes para proteger o cosmético.
O papel da embalagem, desse ponto de vista, será crescentemente importante, uma vez que as tecnologias biocidas tornam-se rapidamente limitadas, pois os microrganismos estão continuamente evoluindo para a superação dos sistemas preservantes já desenvolvidos.
Regulamentação
O papel da embalagem na contaminação microbiana não é muito grande na agenda de regulamentação dos Estados Unidos. No entanto existem normas que poderiam facilmente ser interpretadas para exigência de embalagens e lacres que protejam contra a contaminação microbiana. Se essas normas fossem reforçadas, que métodos de teste nós disporíamos?
Em meados da década de 70, o enfocou a possibilidade de poderem impor agravos microbiológicos ao consumidor. Este tema foi abordado com a opinião de que os únicos mecanismos para lidar com tais agravos eram os testes de eficácia de preservantes (PETS, do inglês, preservative efficacy tests). O FDA considerava impossível prevenir a introdução de micróbios pelos consumidores durante o uso dos produtos.
Entretanto, os PETS não são nada mais do que ensaios de biodisponibilidade para mostrar que os preservantes estão presentes na formulação em estado bioativo. Eles não “prevêm" a possibilidade de contaminação durante a fabricação ou pelo consumidor.
Os únicos modos lógicos são os estudos de uso pelo consumidor que demonstram como o fechamento protege o produto de contaminação. Estudos de uso simulado poderiam não constituir um teste verdadeiro para demonstrar essa proteção.
Expansão dos Micróbios
A contaminação microbiana durante a manufatura foi uma preocupação maior até o advento dos modernos preservantes na década de 1960.5,6,7 Assim como estávamos cegamente encantados nossa capacidade de vencer doenças devastadoras com antibióticos, vencemos os micróbios em nossas fábricas com preservantes. Pouco antevíamos a praga que estava por vir, de microrganismos resistentes aos antibióticos e tolerantes a biocidas.
A natureza nunca é estática. A imutabilidade de espécies é uma mentira no mundo dos micróbios. Sua evolução é rápida. Durante uma única geração humana de 25 anos, um microrganismo passa por 700.000 gerações. Isto equivale a 17,5 milhões de anos de evolução dos primatas. Os biocidas e antibióticos ativos há poucos anos atrás, hoje não agirão contra todos os micróbios.
Breve História de PETs e de Controle Microbiológico
Em 1975 e 1985, o FDA contratou empresas para desenvolver o que se esperava pudessem ser PETs preditivos. Num relatório de avaliação do US Appropriations Committee de 1989, o FDA requisitou fundos para "desenvolvimento e uso de procedimentos de testes microbianos, que assegurem que os sistema preservantes de cosméticos protegem eficazmente os produtos de contaminação microbiana prejudicial durante o uso pelo consumidor." Surpreendentemente, nessa requisição estavam ausentes o desenvolvimento e o uso de procedimentos de teste que assegurem que as embalagens de cosméticos protegem eficazmente os produtos de contaminação microbiana prejudicial durante o uso pelo consumidor.
Em 1990, o CTFA publicou os resultados de um levantamento onde praticamente todas as empresas declaravam ter em andamento programas de correlação PET/uso pelo consumidor.12,13 Em 1994, num estudo custeado pelo FDA, vários testes foram comparados quanto à sua capacidade preditiva de contaminação "em uso."13 Uma crítica feita a esse trabalho foi a de que testes "em uso" foram meramente simulados. O propósito desse estudo, entretanto, não era o de provar a capacidade preditiva do potencial de contaminação pelo consumidor de um teste em particular, mas o de comparar os vários modelos de PET. Como resultado, nenhum dos testes se mostrou capaz de correlações preditivas.
Em 1990, O FDA trabalhou com o CTFA e a Association of Official Analytical Chemists (AOAC) para desenvolver um teste padrão completo, com comparações multilaboratoriais e análise estatística. O estudo cooperativo feito pelo CTFA, AOAC e FDA desenvolveu um protocolo de bases estatísticas, que se mostrou reprodutível e confiável. Esse estuda não procedeu nenhum teste "em uso" usando os mesmos produtos sobre os quais o PET foi conduzido. Também não considerou o papel que a embalagem pode desempenhar na prevenção de contaminação. Contudo, esse estudo foi um excelente exemplo do desenvolvimento de um método estatisticamente analisado, que pode distinguir entre formulações cosméticas adequada e inadequadamente preservadas, conforme determinado pelo teste desafio microbiológico USP XXIII.
O estudo usou quatro diferentes cosméticos em dois níveis de preservantes, e os testou em triplicata em 17 laboratórios (408 pontos avaliados). A determinação da adequação preservante foi baseada em critérios USP XXIII como parâmetros de referência. Cada amostra foi inoculada com 10 microrganismos reunidos em 4 grupos derivados de micróbios de filmes desidratados. Os pools eram gram-negativos fermentadores, gram-negativos não fermentadores, gram-positivos e um inóculo de fungos e leveduras. Foi dada atenção à neutralização. Foi estabelecida a seguinte padronização: mesmo lote/banho de microrganismos de filme desidratado, meios de cultura de um único lote o processamento padronizado de pequenos banhos sem fragrância ou coloração. O critério de aceitação para aprovação ou falha foram aplicados aos produtos preparados a fresco. Esses critérios requeriam redução de log 3 em 7 dias para pools 1-3 de bactérias, redução de log 1 de fungos e leveduras em 14 dias.
Com base neste delineamento experimental, foram obtidos os seguintes dados (Tabela 1). Quarenta e oito (94,1%) de 51 unidades de condicionador adequadamente preservados (determinação USP) foram aprovados no teste colaborativo AOAC CTFA/USP(AOAC-PET). Todas as 51 unidades de condicionador inadequadamente preservadas falharam no AOAC-PET. No que diz respeito ao shampoo adequadamente preservado, 49 das 51 unidades (96,15) foram aprovadas e todas as 51 unidades inadequadamente preservadas falharam no AOAC-PET. Na emulsão a/o, 100% das unidades adequadamente preservadas foram aprovadas no AOAC-PET, e uma das unidades preservadas inadequadamente realmente foi aprovada. Os autores apontaram esse resultado como sendo um falso negativo, atribuído à dificuldade de distribuição do inóculo pelas amostras e à dispersão da amostra no diluente. Finalmente, a emulsão a/o produziu resultados inteiramente consistentes com a previsão. Se pudéssemos sumarizar todos os 408 pontos de avaliação conjuntamente, o teste foi corretamente preditivo de preservação adequada em 97,55%, e corretamente preditivo de preservação inadequada em 99,51% das amostras.
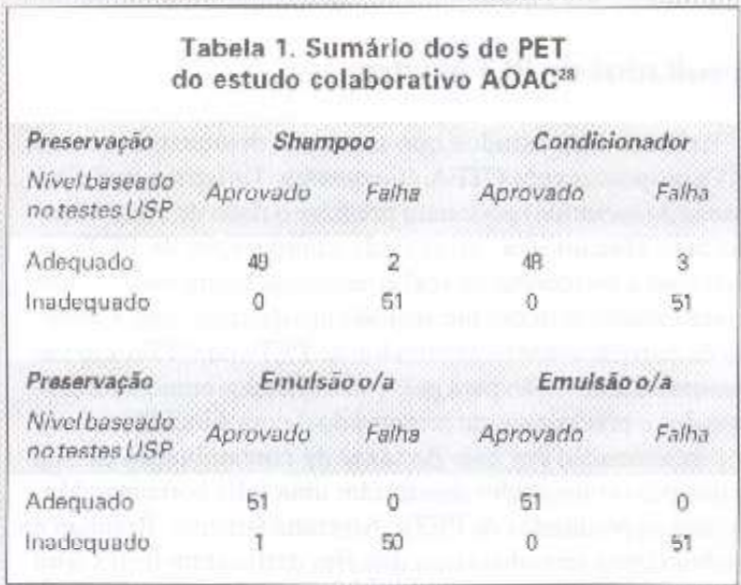
.
Em se admitindo que o teste USP é um preditivo realmente válido em sua capacidade de determinar a eficácia preservante, esses resultados validam o método como acurado e confiável. Considerando que o teste USP é meramente um teste conceitual, desenvolvido por consenso, esta afirmação torna-se difícil, senão impossível, de ser feita. Entretanto, não se considerando a validade, esse exercício colaborativo é um monumento ao bom delineamento estatístico, e prova que um teste de eficácia preservante pode ser feito com alta sensibilidade e especificidade por diversos laboratórios.
Resultados de PET in vitro
Existem dois estudos que tentaram demonstrar que os PETs propostos pela CFTA (Cosmetics, Toiletries and Fragrance Association) poderiam predizer o risco de contaminacão pelo consumidor, através da comparação de PETs in vitro com a incidência de real contaminação em uso.14,15 Um desses estudos utilizou um método prospectivo com a intenção de correlacionar os resultados de PETs da CTFA em um shampoo e uma loção para pele (classificados como bem preservados e precariamente preservados) com a incidência real de contaminação em uso. As taxas de contaminação devida ao uso pelo consumidor mostraram uma feliz correspondência com os resultados de PETs. Afortunadamente, Brannan e colaboradores reconheceram que eles delinearam testes com fechamentos que permitiriam fácil exposição do produto durante o uso pelo consumidor: tampas de rosca e frascos de boca larga. Como resultado, apropriadamente concluíram que "se o desenho do recipiente provê a adequada proteção, mesmo produtos precariamente preservados poderão resistir ao uso pelo consumidor."
Em outro estudo, os pesquisadores Lindstrom e Hawthorn tentaram demonstrar como um PET pode ser redefinido por pareamento de resultados in vitro contra resultados reais de uso pelo consumidor, usando-se uma abordagem de validação retrospectiva.15 Após receber de volta poucas unidades contaminadas do produto, eles modificaram seu PET para incluir concentrações mais elevadas de inóculo, requerimentos de redução microbiana mais rigorosos e testes de preservação acelerados. Os resultados dessas modificações do PET foram então comparados aos dados de uso em campo, constando-se melhora do desempenho.
Embora esses pesquisadores não tenham estabelecido como as embalagens protegem os produtos da contaminação, salientaram que os testes de uso pelo consumidor uma prática rotineira para avaliar a verdadeira capacidade de uma embalagem de manter o produto livre de contaminação. A maioria dos reconhecidos microbiologistas que trabalham com preservação de cosméticos e drogas comprovarão que os testes “em uso” ou "no recipiente" são mais importantes que PETs para avaliar a verdadeira capacidade de um produto de resistir à contaminação.25
Outras regulamentações estabelecem requerimentos de embalagens para drogas, mas somente algumas delas se aplicam aos cosméticos. Nº CRF β1 b211.94 são estabelecidas normas para evitar que recipientes e fechamentos sejam capazes de reagir, adicionar ou absorver, e dessa forma alterar segurança, identidade, potência, qualidade ou pureza da droga. Especificamente o artigo β211.94(b) requer que o fechamento dos recipientes provenham adequada proteção contra previsíveis fatores externos durante estocagem e uso que causem deterioração ou contaminação do produto. Certamente, a embalagem, como um mecanismo protetor contra contaminação microbiana, é uma preocupação do ponto de vista de regulamentação.
Questões acerca de embalagens que têm impacto sobre a investigação de novas drogas e suas aplicações focalizam testes de características físicas da composição, resistência química, transmissão, compatibilidade e migração/lixiviação16 Entretanto, o FDA também requer testes de desafio sobre a integridade de tampas. Essa prova de integridade deve ser feita com recipiente, fechamento e drogas reais e em condições reais. Dessa forma, ficar bem estabelecidas as bases de regulamentação do recipiente como meio de proteção do produto contra a contaminação microbiana pelo consumidor.
Embalagem: Protetor contra Contaminação
A indústria cosmética não está ativamente engajada numa investigação cooperativa de dispositivos de fechamento e dispensação como mecanismos de proteção dos produtos durante o uso. A indústria farmacêutica, entretanto, está bem a este mecanismo de proteção. Em 1995, a Pharmceutical Drug Association (Estados Unidos) reuniu a Container Closure Task Force (CCTF, grupo de trabalhos sobre fechamento de recipientes) para responder a questões sobre "avaliação de integridade de sistemas de fechamento/recipientes de drogas estéreis." O objetivo do CCTT era "investigar metodologias de sistemas de fechamento/recipiente capazes de determinar se um sistema garante adequadamente a integridade microbiológica do produto, inicialmente no longo de sua vida útil.” Embora o CCTF não tenha abordado especificamente o papel da embalagem na proteção do produto durante o uso, este pode vir a ser um projeto futuro desse grupo (comunicação pessoal de T Polson, Glaxo).
A forma de proteção de fármacos durante o uso é especialmente importante para sprays nasais, medicações oftálmicas e antiácidos. O reconhecimento da importância de embalagens protetoras e bem desenhadas se aplica aos produtos farmacêuticos em embalagens multidoses, particularmente os injetáveis.29 A tampa do frasco de medicações oculares tem implicações com ceratite microbiana em pacientes com doenças da superfície ocular. Produtos de uso oral, especificamente antiácidos líquidos, são uma área particularmente preocupante para os farmacêuticos (comunicação pessoal de M Cooper, Microbiological Applications). Estudos publicados indicar que até 92% dos produtos de uso oral se tornam contaminados durante o uso.31 Certamente, o desenvolvimento de embalagens e fechamentos ou dispositivos dispensadores que eliminem ou minimizem o potencial de contaminação durante uso podem ter significativa continuidade no mercado, sobre a qual nós precisamos investir em ambas as indústrias, cosmética e farmacêutica.
Se isso foi feito, não será necessário confiar somente na eficácia preservante de uma fórmula. Ao contrário, o sistema embalagem/fechamento também poderá proteger as fórmulas.
Um estudo demonstrou que os fechamentos podem evitar ou minimizar a contaminação microbiana de produtos não preservados que falham na metodologia da CTFA.32 Dois produtos não preservados (shampoo e loção para a pele) foram avaliados em embalagens com vários níveis de proteção contra contaminação em uso devido ao fechamento (Figura 1). O shampoo foi colocado em frascos com fechamento que não proporciona nenhuma proteção (tampas de rosca comuns com abertura de 24 mm), e em outros com fechamento com alto grau de proteção (uma tampa articulada que cobre a abertura de 6 mm quando o produto não está em uso, flip cap). A loção para pele foi colocada em frascos com tampa de rosca e recipientes com dispensador tipo pump-top.

Usando o PET CTFA modificados, os pesquisadores inicialmente confirmaram que nem o shampoo, nem a loção para a pele haviam sido hostilizados pelos microrganismos, sendo a ausência de microrganismos confirmada por métodos de cultura em placas padrão e meios enriquecidos. Após uso pelo consumidor por duas ou três semanas, o conteúdo microbiano dos produtos usados foi determinado imediatamente ao serem recebidos e quatro a sete dias mais tarde. Os produtos foram considerados contaminados se tivessem conteúdo microbiano maior que 100 CFU/g ou se bactérias gram negativas fossem vistas em qualquer uma das culturas.
Para o shampoo, o flip-cap deu completa proteção, com 0% dos produtos contaminados. A tampa de rosca permitiu que 29% das unidades fossem contaminadas. O nível de contaminação (CFU/g de produto) e a diversidade dos contaminantes foram também computados numa graduação global de extensa de contaminação (Tabela 2). Como resultado, a capacidade protetora do flip-cap foi claramente evidente, por prover completa proteção, mesmo de um shampoo não preservado A tampa de rosca não proporcionou proteção adequada. Usando se os mesmos critérios para a loção para a pele, a tampa de rosca permitiu 71% de contaminação, mas a pump-top permitiu taxa de somente 10% de contaminação.

Concluiu-se que o fechamento flip-cap poderia eliminar completamente a contaminação pelo consumidor de shampoos não preservados. No caso de loções para a pele não preservadas, a contaminação foi significativamente reluzida (de 71% para 10%) pelo pump-top. Torna-se claramente significativo o papel desempenhado pelo fechamento na proteção contra contaminação. São necessários maiores estudos para melhor definir como a embalagem previne a contaminação pelo consumidor - particularmente de produtos que requerem aplicadores.
Outras Considerações
Interações embalagem/produto: Obviamente, os materiais de embalagem e fechamento deverão ser compatíveis com o produto.33,34 Os fabricantes de preservantes, bem como os fornecedores de outras matérias-primas, deverão incluir uma relação da compatibilidade de resinas plásticas e corantes. Além disso, o efeito da estocagem a longo prazo deverá ser avaliado, pois um preservante pode ser adsorvido pelo material do recipiente, inativado pelos corantes usados nas plásticos ou perdido por sua própria volatilidade.
Quando conduzem estudos de estabilidade a longo prazo, os microbiologistas devem incluir análise química dos fatores preservantes da formula. Isto torna possível a localização de falhas dos PETs devidas a prejuízo ou perda dos fatores preservantes, resultantes de interações com a embalagem. Se os preservantes continuam presentes na fórmula, mas o produto tem falhas aos PETs, algo mais está agindo para impedir que os microrganismos entrem em contato com os fatores biocidas da fórmula. Por exemplo, pode haver partição do preservante da fase aquosa para a fase oleosa de um produto. Se isso ocorre, o preservante não estará de maneira alguma disponível para os microrganismos, que sobrevivem somente em água.
Embora algumas embalagens inative preservantes,35 outras realmente exibem atividade biocida. É o que ocorre, por exemplo, quando um unguento embalado em tubos de metal elimina o inóculo bacteriano.36 Os pesquisadores atribuem esse resultado a exclusão de oxigênio no tubo de metal; o fato de que muitos metais são inerentemente biocidas também deve ser considerado.
Rótulos
E importante usar adesivos e selantes que possam ser protegidos contra o crescimento microbiano, especialmente de fungos.37,38 Os rótulos devem também instruir os consumidores a descartar ou inutilizar o produto após uma data específica. Rímel por exemplo, deve ser descartado após três meses.
O Futuro
Protegendo da contaminação em uso:
Para reduzir os níveis de preservantes em cosméticos, é importante desenvolver embalagens e dispositivos de dispensação protetores, que previnam a contaminação de um produto pelo consumidor enquanto ele estiver em seu recipiente. Flip-cap para shampoos e pump-tops para loções são o primeiro passo desse ideal. Para dar o passo seguinte, dever-se-ia desenvolver uma tampa flip-top que se abrisse automaticamente quando o frasco fosse invertido e se fechasse quando fosse novamente colocado para cima. Para os pumps, seria útil uma válvula em que o deslocamento positivo não permitisse o refluxo do produto para dentro do sifão. Algumas companhias já estão investigando como prevenir isso usando dispensadores que fornecem uma dose controlada no acionamento de spray de uma única via.52 Diversas patentes já estão registradas para fechamentos que previnem a contaminação em uso de líquidos não viscosos.54,55 Esses dispositivos são compostos por um diafragma de vedação em membrana de 0,45 PTFE, que permite a equalização do ar após a dispensação. Após dispensar o liquido pelo diafragma comprimindo-se frasco, o diafragma se abaúla para prevenir o refluxo, enquanto continua permitindo a entrada do ar e a equalização do frasco. Infelizmente, esta tecnologia só funciona para produtos não viscosos.
Para rímel e outras maquilagens de olhos, bastões e pinceis aplicadores em infusão de biocida ou feitos de materiais que previnem a aderência de microrganismos também seriam um passo na direção correta.47 Recipientes estéreis de monodoses são basicamente usados somente para produtos dimensionados para provas em mostruários de maquilagem.48 Algumas companhias comercializam produtos sem preservantes em recipientes herméticos estéreis para dispensar seus produtos de uma maneira que evite contaminação.49 Para produtos para os cabelos. shampoos e loções, os sistemas de dispensação podem ser modificados para mousses em aerosol. Com o advento da tecnologia "bag-in-can", uma ampla variedade de cremes, géis, loções e pastas podem ser dispensadas na forma de aerosol, que seria virtualmente a prova de contaminação.50 Uma companhia atualmente usa esta tecnologia para dispensação de geleia de petróleo, um produto anidro e que, portanto não requer preservantes, mas necessita proteção contra poeira e umidade.
Outra desenho de embalagem patenteado é o bag-within-a-bag, apropriado para infusões parenterais por proteger seu conteúdo da luz e de contaminação microbiana antes do uso.56 Num esforço para resolver a questão da contaminação de antiácidos, foi patenteada uma composição antiácida reidratável, à qual se adiciona água na momento do uso.57 Entretanto, até o agora, nenhuma dessas abordagens o aplicável aos cosméticos, como são às drogas.
Nota final:
O desenvolvimento de embalagens protetoras considerando a demanda do consumidor pode colocar algumas ironias conflitantes. Os consumidores de hoje criam uma demanda por produtos livres de preservantes que evitem a contaminação durante o uso. Eles também exigem embalagens biodegradáveis. Os consumidores necessitam proteção contra micróbios durante o tempo de uso de um produto, mas os micróbios são necessários à posterior degradação... Uma nova resina plástica parece ter resolvido esse problema, pois é completamente biodegradável.58 Ironicamente, é fabricada a partir de Alcaligenes eutrophus, uma bactéria! Uma embalagem feita a partir de uma bactéria, que protege contra bactérias, mas é degradada por bactérias e, decerto, um singular contrassenso. N
Este artigo foi publicado na revista Cosmetics & Toiletries (Edição em Português), 10(4): 66-71, 1998.
Publicado orginalmente em inglês, Cosmetics & Toiletries 113(4):79-90, 1998.
1. Investigating cases of product contamination. Cosmet Toile Manufac Supp June, 37, 1994
2. Haw AH. Prerserving the future, Soap Cosm Chem Sp 68 26-28, 1992
3. Romanowski P. Schueller R. Cosmetic Product Packaging, Cosm Toil 112, 65-73, 1997
4. Cosmetic Packaging Quality Control, Household Personal Products Industry April, 36, 1996
5. Curry JC, Cosmetic microbiology: 50 years of change, Household Personal Products Industry 8. 44-52, 1983
6. Morse LJ, Williams HL, Graen.Jr FP, Eldridge EE, Rotta JR. Septicemia due to Klebsiella pneumoniae originating from a hand cream dispenser. N Engl J Med 277, 472-473. 1967
7. Noble WC, Savin JA. Steroid cream contaminated with Pseudomonas aeruginosa, Lancet 1, 347-349, 1966
8. Wilson LA, Ahearn DG. Pseudomonas-induced corneal ulcers associated with contaminated eye mascaras. Am J Ophthalmol, 84, 112-119, 1977
9. Wilson LA, Julian Al, Ahearn DG. The survival and growth of micrroorganisms in mascara during use. Am J Ophthalmol 79, 596-601, 1975
10. Dawson NL, Reinhardt D. Microbial flora of in-use, display eye shadows testers and bacterial challenges of unused eye shadows, Appl Environ Microbiol 42, 297, 1981
11. CTFA Microbiology Committee. CTFA Survey: preservative test methods companies use, Cosm Toil 105, 79-82, 1990
12. Spielmaker RJ. Report of a cosmetic industry survey concerning correlation of preservative challenge and consumer test results; J Soc Cost Chern 36, 5, 1985
13. Farrington JK Martz EL, Wells EL, Ennis CC, Holder J, Levchuk JW, Avis KE, Hoffman PS, Hitchensand AD, Madden JM. Ability of laboratory methods to predict in-use efficacy of antimicrobial preservatives in an experimental cosmetic, Appl Environ Microbiol 60, 4553-8, 1994
14. Brannan DK, Dille IG, Kaufman DJ. Correlation of in vitro challenge testing with consumer useo testing for cosmetics products, Appl Environ Microbiol 53, 1827-32, 1987
15. Lindstrom SM, Hawthorn JD. Validating of the microbilogical integrity of cosmetic products through consumer use testing, J Sc Cosm Clem 37, 481-8, 1986
16. Guideline for Submitting Documentation tor Packaging for Human Drugs and Biologicals, US Department of Health and Human Services, Food and Drugs Administration, February, 1987
17. Notice of intent to propose regulations and request for information on preservation of cosmetics coming in contact with eye, Fed Reg 45, 54837-8, 1977
18. Brannon DK Cosmetic proscrvation, J Soc Cosm Chem 46. 199, 1995
19. Evaluation of methods for determining preservative efficacy, CTFA Cosm J, 5, 2-7, 1973
20. Determination of adequacy of preservation of cosmetic and toiletry formulations, CTFA Technical Guidelines, CTFA, Washington DC, 1983
21. Ahearn DG, Sanghvi J, Haller GJ, Wilson LA. Mascara contamination: in use laboratory studies. J Soc Cosm Chem 29. 127-31, 1978
22. Dawson NL, Reinhardt DJ. Microbial flora of in-use, display eye shadow testers and bacterial challenges of unused eye shadows. Appl Environ Microbiol 42, 297 302, 1981
23. Cowen RA. Relative merits of in use and laboraratory methods for evaluation of antimicrobial products, J Soc Cosm Chem 25, 307-23, 1974
24. Farrington JK. Marlz EL Wells SJ, Ennis CC, Holder J, Levchuk WJ, Avis KE, Hoffman PS, Hitchina AD; Madden JM. Ability of laboratory methods to predict in-use efficacy of antimicrobial proservatives in an experimental cosmetic, Appl Envason Microbiol 60, 4553-8. 1994
25. Sabourin JR. Evaluation of preservation for cosmetic produces, Drug Cosm indus 147, 24-7, 1990
26. Tran TT, Hitchins AD. Microbial survey of shared-use cosmetic test kits avaliable to the public, J Ind Microbiol 13, 389-91. 1994
27. Tran TT, Hurley FJ, Shurbaji, Koopmam LB. Adequacy of cosmetic preservation; chemical analysis, microbial challenge and in use testing, Int J Cosm Sci 16, 61-76. 1994
28. Fishler G e CTEA Microbiology Committee. Determination of the efficacy of preservatives of non-eye area water miscible cosmetic and toiletry formulations: Collaborative study, Society for Cosmetics Chemists Annual Scientific Seminar, 1997
29. Christensen EA, Mordhorst CH, Jepsen DB. Assessment of risk of microbial contamination by use of multi-dose containers of injectable products, J Hospital Infection 20, 301, 1992
30. Schein OD, Hibberd PL, Starek T, Baker AS, Kenyon KR. Microbial contamination of in-use ocular medications, Arch Ophthalmol 110, 82-5, 1992
31. Patel MR, Patel AA, Gandhi TP, Gandhi NP, Joseph AR, Cadila D. Microbial contamination of oral liquid medications: A survey, Indian Drugs 22, 234-7, 1985
32. Brannan DK, Dilla JC. Type of closure prevents microbial contaminations of cosmetics during consumer use, Appl Environ Microbiol 56. 1478-9. 1990
33. Parker MS. Preservation of pharmaceutical and cosmetis products, Principles and Practica of Disinfection Preservation and Sterilization, 2nd edh. (eds AD Ruscel, WB Hugo, GAJ Ayliffe) Blackwell Scientific Publications, London, 335-50,1992
34. McCarthy TJ. Interation between aqueous preservative solutions and their plastic containers, Pham Weekbl 105, 557-63. 7739-46, 1970
35. Lachman L, Urbanyl L. Weinstein S. Stability of antibacterial preservatives in parenteral solutions IV. Contribution of rubber closure composition on preservative loss J Pharm Sci 52, 244-9. 1963
36. Abu Shaqra QM, Husari NT. Fate of some types of bacteria in hydrocortizone acetate oitmant, intl Biodeterioration 23, 115-20.1987
37. Friedman M, Casali F, Stamm J. Selecting the proper biocide for adhesives and selants, Adhesives Age, February, 29-32, 1988
38. Seidel P, Coded labels: GMP safety controlled by computer, Verpackungs-Rundschau 43. 79-80, 1992
39. McCarthy T. Sources of microbial contamination, Phamm Cosm Rev 18, 31-2, 1991
40. Aseptic advances ensure clean conditions for pharmaceuticals, Manufact Chem, June 13, 1995
41. Brannan DK. Cosmentic microbiology, Encyclopedia of Microbiology Ed Lederberg, Academic Press, San Diego 1, 593-603, 1993
42. Guise W. Packaging under clean room conditions, Packaging 64,2-7, 1993
43. Compressed air purification for the pharmaceutical industry. Pharmacounival Manufacturiny Review 5, 76, 1993
44. Morrissey RE, Prokopenko Yl, eds, Sterilization of Medical Products, Vol 5, Polyscience Publications, Canada, 1991
45. Phillips GB, Miller WS, eds, Industrial Sterilization, Interantional Symposium, Amsterdam 1972. Duke Universily Press. Durhami, North Carolina, 1973
46. Merieux DT vaccine: Merieux UK introduces prefilled syringe diphtharia/tetanus vaccine, first in UK in 27 years. Chemist Druggist October 608. 1991
47, Edmundson RJ, Baker CG. Techinical aspects of formulating lash and brow makeup products, Cosm Toil, April 39-42, 1979
48. Anchor Advanced Products offering Testix cosmetic Sampling system. FDC Reports Rose Sheet, July 16, 1990
49. Monteil Paris launches ICE Monteil skin cleansing and misturizing products in US market, Cosm Toil 108(6):16, 1993
50. Aerosol International - Developing the products of the future, Coms Toil Manufact Supliers, Setember, 24, 1997
51. Aerosol petroleum jelly reduces sanitary woes. Food Drug Packaging, March 9, 69, 1985
52. Boerhinger Ingelheimis Nostril and Nostrilla markated in a unique dispenser sistem which provides a controlled dose. Drug Cosmet Indus, January. 61, 1983
53. Raralletta JV, Williams Jr FE, Kanner RW. Liquid dispenser nozzle assembly, US Patent No. 5.025.957 to Ryder Intarnational (June 25, 1991)
64. Ryder FE, Kanner RW, Rabenau R. Solution delivery nozzly and system with antimicrobial features. US Patent No. 5.154.325 to Ryder International (Oct 13, 1992)
65. Kanner RW, Nevelli GM. Liquid dispenser nozzle assembly. US Patent No. 5.431.310 to Ryder International Corp (Jul 11.1995).
56. Bennwik P, Hjertman B. Package. US Patent No. 4.411.358 to Vitrum AB (Dec 7, 1981)
67. Chien Chin W et al. Rehydratable antacid composition. US Patent No. 4.676.984 to American Home Products Corp (Jun 30, 1987)
58. Gilbert R. Bottles for natural shampoos fade away: containers biodegrade quickly, Food Drug Packaging 56, 1992
59. Tattersul l. The Human Odyssey: Four Million Years of Human Evolution. Prentice Hall, New York 1993
60. Wilson DS. Human groups as units of selection, Science 276, 1816-7. 1997


Deixar comentário
Para comentar é preciso fazer login no sistema.